Long-COIVDに関する論文第3弾です。
きっかけは日経メディカル電子版2023/11/07に載っていた記事から。
>COVID-19後遺症の原因の1つはセロトニン減少か
この記事は次の論文をもとに書かれています:
”Serotonin reduction in post-acute sequelae of viral infection
(ウイルス感染の急性後遺症におけるセロトニンの減少)”
出典は、Cell VOLUME 186, ISSUE 22, P4851-4867.E20, OCTOBER 26, 2023
Opne accessです。
上記論文のSummaryをいつものようにDeepL簡易版で訳してみます。
「要約
COVID-19(PASC、”Long-COIVD”)の急性後遺症は、世界的に重大な保健上の課題となっている。病態生理学は不明であり、現在までに有効な治療法は見つかっていない。PASCの病因を説明するために、ウイルスの持続性、慢性炎症、凝固亢進、自律神経機能障害などいくつかの仮説が立てられている。ここでは、4つの仮説すべてを1つの経路で結びつけ、治療的介入のための実用的な洞察を提供するメカニズムを提案する。我々は、PASCがセロトニンの減少と関連していることを発見した。すなわち、セロトニン前駆体であるトリプトファンの腸管吸収の低下、セロトニン貯蔵に影響を与える血小板の活性化亢進と血小板減少、MAOを介したセロトニンの代謝亢進である。末梢のセロトニンが減少すると、迷走神経の活動が阻害され、海馬の反応と記憶が損なわれる。これらの知見は、Long-COVIDにおけるウイルス持続に伴う神経認知症状の説明となり、他のウイルス感染後症候群にも及ぶ可能性がある。」
グラフィカル・アブストラクト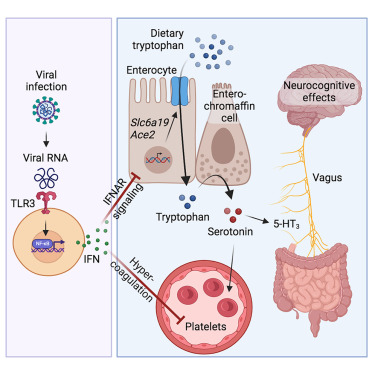
COVID-19の急性後遺症は、Long-COIVDとか、
Post-acute sequelae SARS-CoV-2 infection (PASC)と呼びますが、
これらは、世界的に重大な健康上の課題となっていますが、
病態生理学は不明であり、現在までに有効な治療法は見つかっていません。
Long-COIVDの後遺症を、
当初、Post-Acute-Covid-Syndrome (PACS)と呼んでいました。
そのあたりのことは、当院ブログでも取り上げました。
>Post-acute COVID-19 syndrome1~4
PASCとPACSは同じなのかどうかわかりません。
ただ、論文を読んでいくと、何となく、
PACSは強い肺炎などの後の呼吸器障害や、
脳血管障害、心血管障害などの後遺症も広く含むのに対し、
この論文で取り上げているPASCは、
後遺症の中でも、倦怠感やBrianFog(脳霧)など、
特に自律神経症状や精神認知症状を中心とした後遺症を
指す様な気がします。
PASCの病因を説明するために、一般的に
ウイルスの持続性、慢性炎症、凝固亢進、自律神経機能障害など
いくつかの仮説が立てられています。
この論文では、この4つの仮説すべてを1つの経路で結びつけ、
治療的介入に実用的な洞察を与えるメカニズムが提案されています。
まず、急性感染から3~22ヵ月後に症状が持続した
58人のLong-COIVD患者を対象に
急性COVID-19患者60人および
COVID-19から無症状で回復した患者30人とを
標的血漿メタボロミクス(代謝物を網羅的に解析する方法)を
実施し比較しました。
COVID-19の急性期と急性期後の両方で
レベルが低下している分子群が同定され、
そのうち最も重要なものは
セロトニン(5-ヒドロキシトリプタミン、5-HT)でした。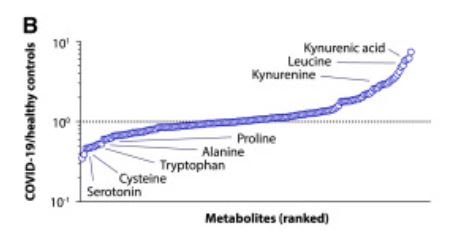
グラフの見方がよくわかっていないのですが、
いろいろな代謝産物の量を、
COVID-19の患者さんと健康な人で比を求めて順番に並べたものと思います。
一番左Serotoninがあり、COVID-19で最も少なくなっています。
次に、セロトニンの減少がCOVID-19に特有なのか、
他の急性ウイルス感染でも同様の減少が見られるのかを調べたそうです。
非SARS-CoV-2全身性ウイルス感染症患者33人の
血漿中のセロトニン濃度を測定し、
健常対照者20人と比較したところ、
急性COVID-19の場合と同様に、
セロトニンレベルは他のウイルス感染によって強く低下していたそうです。
これは全身性ウイルス感染の
より一般的な特徴である可能性が示唆されました。
このセロトニン減少がなぜ起こるのかを、
さらに踏み込んで調べてみたそうです。
動物実験で、ウイルス感染等を起こさせると、
インターフェロン刺激遺伝子(ISG)のレベルが強く上昇するのだそうです。
そして、実際にI型インターフェロンの持続的な上昇が
Long COVID患者で観察されているそうです。
これは、TLR3によるウイルスRNA感知と
I型インターフェロン誘導が亢進し、セロトニン枯渇につながる様です。
この論文ではさらに、
ウイルスによる炎症がセロトニンレベルを低下させるメカニズム
についても検討しています。
循環セロトニンの大部分は消化管で産生され、
そこで食餌性トリプトファンからエンテロクロマフィン細胞で合成されます。
急性COVID-19患者や、さらにLong-COIVD患者では
血漿中のトリプトファン濃度が低下していることがわかったそうです。
途中ちょっと省略しますが、
ウイルス性RNAによって誘発された炎症によって、
腸のトリプトファン取り込みが障害され、
全身性のセロトニン枯渇が引き起されるのだそうです。
さらに、ウイルス性炎症では、凝固機能が亢進し、
血小板凝集が顕著に増強されるらしく、
ウイルスの炎症が血小板の活性化を促進し、
インターフェロン依存的に凝固能亢進と血小板減少を引き起こすとのこと。
循環セロトニンは腸管内のエンテロクロマフィン細胞で合成されたのち、
血小板内に輸送されて、貯蔵されるのだそうですが、ウイルス性炎症では、
血小板を介した全身のセロトニン輸送も障害されているわけです。
さらに、モノアミンオキダーゼ(MAO)による
セロトニンの分解も亢進しているそうです。
Long-COIVDでは、認知機能障害も重要な症状の一つです。
短期記憶の獲得は海馬によって駆動されていて、
COVID-19患者では海馬の活動が低下していることが報告されているそうです。
セロトニンは海馬の機能において重要な役割を果たしていますが、
脳内のセロトニンレベルはウイルス性炎症の影響を受けなかったことから
セロトニンの末梢での減少が認知障害の原因であるとのことでした。
なんか、てんこ盛りの論文で、
かなり消化不良で申し訳ありません。
とりあえず、
SARS-COV2をはじめとするウイルス疾患に感染した場合、
腸管でのトリプトファン吸収が障害され、
その結果、腸内のエンテロクロマフィン細胞での
セロトニン合成が低下し、
さらに、血液中で凝固機能が亢進するため、
血栓形成が亢進、結果的にセロトニンの貯蔵庫である血小板も減少、
さらに、セロトニンの分解が亢進されるため、
ますますセロトニンが枯渇する。
その結果、海馬の活動が低下する。
これがLong-COIVD,PASCの本体だろうということです。
血栓形成が亢進するという話は、
COVID-19が流行してきたころから聞いています。
SARS-COV2ウイルスのスパイク蛋白が、
ACE2受容体に結合し、それを足がかりに細胞に侵入する
というのが、初期のSARS-COV2の振る舞いでした。
(変異型はACE2を介さない経路で侵入するとも言われています)
その際、血管内皮細胞でこれが起こると
血管内皮細胞が障害を受け、血栓を起こしやすくなる様です。
↑
これ、mRNAワクチンの理論が、
身体にスパイク蛋白を作らせて
免疫細胞に覚えさせようというものですから、
ワクチンにも血栓症を起こしやすい傾向はあると思います。
とすると、時にワクチンでも
PASCに似た症状がでる可能性もあるかもしれません。
Long-COIVDの方も、ワクチン後の不調の人も、
結局セロトニンの減少かもしれません。
治療はここに焦点を合わせるのがいいのかもしれません。
